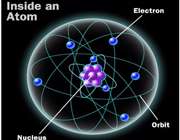
ساختار اتم
در آزمایش ها نیز مشخص گردید که اتم ها نیز خود از ذرات کوچک تری ساخته شده اند. در مرکز یک هسته کوچک مرکزی مثبت متشکل از ذرات هسته ( پروتون ها و نوترون ها) و بقیه اتم فقط از پوسته های متموج الکترون تشکیل شده است. معمولا اتم های با تعداد مساوی الکترون و پروتون، از نظر الکتریکی خنثی هستند.
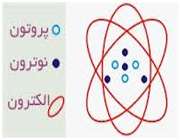
ذرات سازنده اتم
الکترون: دارای بار منفی و جرم ناچیز است و به دور هسته می چرخند
پروتون: دارای بار مثبت و جرمی معادل 1840 برابر الکترون و تعیین کننده نوع اتم نوترون: بدون بار الکتریکی (خنثی) با جرمی معادل جرم پروتون
عدد اتمی (Z)
به تعداد پروتون های هر اتم(به تعداد بارهای مثبت اتم) عدد اتمی می گویند برای مثال اتم سدیم 11 پروتون دارد, پس عدد اتمی سدیم 11 است. عدد اتمی را گوشه پایین سمت چپ نماد شیمیایی می نویسند 11Na
عدد جرمی (A)
به مجموع تعداد پروتون ها و نوترون های یك اتم عدد جرمی گفته می شود.
تمام اتم های یك عنصر پروتون های یكسان دارند اما تعداد نوترون های آن ها می تواند متفاوت باشد.
عدد جرمی در گوشه بالا و سمت چپ نماد شیمیایی نوشته می شود مثلا اتم كربن در هسته خود 6 پروتون و 6 نوترون دارد پس عدد جرمی آن 12 است. 12C
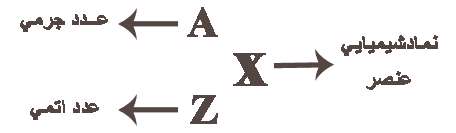
شیمیدان ها برای بیان جرم عنصرها بدین صورت عمل کردند که: فراوان ترین ایزوتوپ کربن یعنی کربن 12 را به عنوان استاندارد انتخاب کردند و جرم عنصرهای دیگر را با استفاده از نسبت هایی که در محاسبات آزمایشگاهی بدست آمده بود، بیان کردند.
به عنوان مثال جرم اتم اکسیژن 33/1 برابر جرم اتم کربن است. با توجه به این که جرم اتم کربن 12 می باشد جرم اتم اکسیژن را محاسبه کرد. در این مقیاس جرم اتم اکسیژن برابر 16خواهد شد.
واحد جرم اتمی amu است که کوتاه شده ی عبارت atomic mass unitاست. در این مقیاس جرم پروتون و نوترون lamu است.
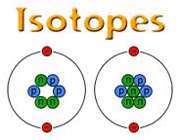
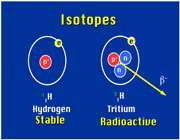
ایزوتوپ
ایزوتوپ ها، اتم های یك عنصر هستند كه در تعداد نوترون و در نتیجه عدد جرمی با هم تفاوت دارند اما عدد اتمی آن ها یكسان است.
مثلا هیدروژن دارای سه ایزوپ است.

بیشتر عناصر، یك ایزوتوپ معمول و چند ایزوتوپ كمیاب دارند به ایزوتوپ های كمیاب تر ناخالصی های ایزوتوپی می گویند.
مثلا ایزوتوپ معمول ئیدروژن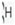 است كه 9/99 درصد كل هیدروژن های موجود در طبیعت را شامل می شود. كم تر از 1/0 درصد را
است كه 9/99 درصد كل هیدروژن های موجود در طبیعت را شامل می شود. كم تر از 1/0 درصد را 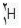 و مقدار ناچیزی را
و مقدار ناچیزی را 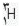 شامل می شود.
شامل می شود.

هنگامی که به وسیله اتم، یک یا چند الکترون از یک اتم دیگر جدا می گردد، یون ها ایجاد می شوند. یون ها اتم هایی هستند که به علت عدم تساوی تعداد پروتو ن ها و الکترون ها، دارای بار الکتریکی ویژه می شوند. یون هایی که الکترون(ها) را بر می دارند، آنیون (anion) نامیده شده و بار منفی دارند.
اتمی که الکترون(ها) را از دست می دهد کاتیون (cation) نامیده شده و بار مثبت دارد. کاتیون ها و آنیون ها به علت نیروی کولمبیک(coulombic) میان بارهای مثبت و منفی، یکدیگر را جذب می نمایند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

